-
 仪表网手机版
仪表网手机版
手机访问更快捷
 仪表网小程序
仪表网小程序
更多流量 更易传播
-
 公众号:ybzhan
公众号:ybzhan
随时掌握行业动态
 扫码关注视频号
扫码关注视频号
网络课堂 行业直播
阿尔茨海默病(AD)是常见的痴呆类型,约 4400 万人受其困扰,患者会逐渐出现记忆衰退与认知退化。近年临床证据明确 “神经炎症” 是 AD 发病核心 —— 分子影像学可捕捉 AD 患者脑内炎症信号,死后脑组织分析也证实 AD 病理中存在显著炎症改变。
目前,脑内驻留免疫细胞(如小胶质细胞)因 AD 相关病理(如 Aβ 斑块)过度激活、加速神经退行的研究已较成熟,但外周免疫系统在 AD 神经炎症中的作用仍不明确。作为外周免疫关键组成的外周单核细胞,其如何影响 AD 神经炎症、是否推动疾病进展,是亟待解答的问题。
为攻克这一研究难题,2025 年 8 月《Science Advances》(IF=13.6)发表题为 “Understanding monocyte-driven neuroinflammation in Alzheimer’s disease using human cortical organoid microphysiological systems” 的研究(文件编号:sciadv.adu2708.pdf)。团队开发人类皮质类器官微生理系统(hCO-MPSs),在体外模拟近人体脑微环境,清晰揭示 AD 患者外周单核细胞驱动神经炎症的分子机制,既为 AD 研究提供更精准的模型,也打开了外周免疫调控 AD 的新方向。

AD 作为常见的痴呆类型,其核心病理机制与神经炎症密切相关。临床研究通过分子成像和死后脑分析证实,AD 患者存在显著神经炎症改变,但外周免疫系统(尤其是单核细胞)在 AD 神经炎症中的作用长期未被阐明 —— 关键障碍在于缺乏适配的人类体外模型:
• 传统 2D 细胞模型无法还原大脑 3D 组织结构,细胞间互作及代谢反应与体内生理状态差异显著;
• 动物模型存在物种壁垒,难以复刻人类 AD 特异性病理(如单核细胞与 Aβ 斑块的相互作用);
• 常规球形类器官易出现中心坏死、缺氧问题,且缺乏免疫细胞组分,无法研究免疫 - 神经动态互作过程。
为破解这一困境,研究团队构建 hCO-MPSs,其设计理念聚焦 “还原人类脑微环境、支持免疫整合、提升实验可操作性”,为 AD 神经炎症机制研究提供了全新工具。
研究的核心亮点在于通过结构优化与体系设计,解决了传统类器官的核心短板,大幅提升模型的生理相关性与实验适用性:
团队将类器官设计为 “甜甜圈” 结构(平均环宽 0.5mm),通过增大表面积 / 体积比,实现氧气与营养物质的高效渗透,消除传统球形类器官(平均半径 0.9mm)因扩散限制导致的中心缺氧区。
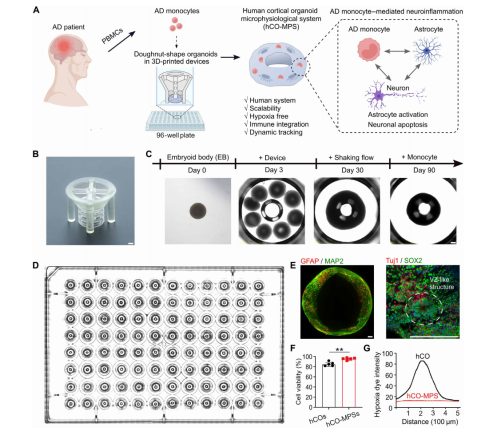
图1. hCO-MPSs在理解阿尔茨海默病单核细胞介导神经炎症中的作用。
实验结果显示,hCO-MPSs 中细胞存活率显著高于球形类器官,且可分化出成熟神经元(MAP2⁺)、星形胶质细胞(GFAP⁺),并形成类似人类大脑的室管膜区(VZ)样组织结构; bulk RNA 测序进一步证实,甜甜圈形类器官中神经元发育相关通路显著上调,细胞周期调控、凋亡及应激反应通路下调,细胞成熟度与皮质特异性显著提升。
团队通过体系优化,使 hCO-MPSs 可适配常规 96 孔板,单次实验可同步培养 96 个类器官微生理系统,且支持单核细胞高效加载与培养基稳定灌注 —— 无需依赖复杂微流控设备,普通实验室借助常规细胞培养仪器即可开展高通量实验,大幅降低了技术门槛,同时保障了实验重复性。
依托 hCO-MPSs 的结构适配性,团队实现了 24 小时延时成像,实时观察单核细胞向类器官的浸润动态;结合单细胞 RNA 测序(scRNA-seq)、批量 RNA 测序(bulk RNA-seq)及免疫荧光染色等技术,从细胞行为、分子表达、通路调控等多维度解析单核细胞与脑类器官的互作机制,为 AD 神经炎症研究提供了 “动态观察 + 深度验证” 的完整技术链。
基于 hCO-MPSs 模型,团队明确 AD 患者单核细胞在神经炎症中的关键作用,为 AD 机制研究与治疗靶点发现提供重要依据:

图2.阿尔茨海默病(AD)患者与AC供体单核细胞浸润研究
1. AD 单核细胞浸润能力显著增强:与年龄匹配的健康对照(AC)单核细胞相比,AD 单核细胞向类器官的浸润量提升约 1.8 倍;Aβ 预处理(模拟 AD 脑病理环境)可进一步增强 AD 单核细胞的浸润能力,而对 AC 单核细胞无显著影响。scRNA-seq 显示,AD 单核细胞中 CCR1、SEMA6B、FGR 等迁移相关基因表达显著上调,揭示其细胞内在特性驱动浸润能力增强。
2. AD 单核细胞 Aβ 清除能力受损:免疫荧光共定位分析显示,AC 单核细胞与 Aβ 的共定位率显著高于 AD 单核细胞;分子机制上,AD 单核细胞中 FCER1G、FCGR2A、TYROBP 等吞噬相关基因,及 RAB5A、CLU 等 Aβ 代谢相关基因表达下调,提示其吞噬与清除 Aβ 的功能受损。
3. AD 单核细胞加剧神经炎症损伤:AD 单核细胞与类器官共培养后,星形胶质细胞活化标志物 GFAP 的荧光强度提升 2.3 倍,活性氧(ROS)生成量显著增加;同时,神经元凋亡比例(TUNEL⁺/NeuN⁺)提升 3 倍,且突触组织、神经元发育相关通路显著下调。进一步研究发现,IL-1β 与 CCL3 是关键调控因子 ——ELISA 证实 AD 单核细胞共培养体系中 IL-1β、CCL3 蛋白水平显著升高,中和这两种细胞因子可使星形胶质细胞活化及神经元凋亡程度降低 60% 以上。

图 3:IL-1β/CCL3 中和实验对神经炎症的改善图
针对研究中涉及的 “类器官高质量培养、免疫细胞共培养、动态追踪、功能验证” 等核心需求,泽汇拥有类器官整体解决方案,覆盖实验全流程,助力科研团队高效复现前沿成果、突破实验瓶颈:

免责声明
客服热线: 15024464426
加盟热线: 15024464426
媒体合作: 0571-87759945
投诉热线: 0571-87759942

下载仪表站APP

Ybzhan手机版

Ybzhan公众号

Ybzhan小程序